|
|||||||
  |
|
|
Konu Araçları |
| açıklaması, atom, cetvel, maddenin, periyodik, yapısı |
Maddenin Yapısı ve Atom - Periyodik Cetvel ve Açıklaması |
|
|
#1 |
|
Şengül Şirin

|
Maddenin Yapısı ve Atom - Periyodik Cetvel ve AçıklamasıMaddenin Yapısı ve Atom - Periyodik Cetvel ve Açıklaması Madde, atom adı verilen taneciklerden oluşur  Atom maddenin yapı taşıdır Atom maddenin yapı taşıdır Atomun yapısında proton, nötron ve elektron bulunur  Proton ve nötron atomun çekirdeğinde yer alır  Elektron ise çekirdek etrafında dolanır Elektron ise çekirdek etrafında dolanır Atomu oluşturan tanecikler belli başlı özellikleri vardır  Proton: Atomun çekirdeğinde bulunur  (+) yüklü bir parçacıktır (+) yüklü bir parçacıktır Kütlesi 1 akb’dir Kütlesi 1 akb’dir Nötron: Atomun çekirdeğinde bulunur  Kütlesi hemen hemen protona eşittir Kütlesi hemen hemen protona eşittir Elektrik yükü taşımaz Elektrik yükü taşımaz Yani yüksüz bir parçacıktır Yani yüksüz bir parçacıktır Elektron: Atomun çevresinde çok büyük hızla dönen hareketli bir parçacıktır  Elektronlar çekirdek etrafında farklı enerji seviyelerinde dolanır Elektronlar çekirdek etrafında farklı enerji seviyelerinde dolanır Atom çekirdeğinin çapı, atom çapının 100 binde biri kadardır  Atom çekirdeğinde yüklü olarak sadece protonlar bulunduğu için, atomun çekirdek yükü daima (+) artıdır Atom çekirdeğinde yüklü olarak sadece protonlar bulunduğu için, atomun çekirdek yükü daima (+) artıdır 1 Karbon atomunun kütlesinin 1/12’sine, 1 atomik kütle birimi adı verilmiştir  Atomik kütle birimi akb ile gösterilir Atomik kütle birimi akb ile gösterilir 1 Karbon atomu = 12 akb’dir  Kimyasal hesaplamalarda atomların kütleleri gram cinsinden değil, akb cinsinden alınır  Atom numarası: Bir element atomunun çekirdeğinde bulunan proton sayılarının toplamına, atom numarası adı verilir  Atom numarası Z ile gösterilir Atom numarası Z ile gösterilir Z = p Kütle numarası: Bir atomun çekirdeğindeki proton ve nötron sayılarının toplamı, o atomun kütle numarasını verir  Kütle numarası A ile gösterilir Kütle numarası A ile gösterilir Kütle numarası = Proton sayısı + Nötron sayısı A = p + n Nötr ve Yüklü Atom: Bir atomdaki proton ve elektron sayıları birbirine eşitse bu atoma nötr atom denir  Nötr atomda (+) ve (–) yükler birbirine eşittir Nötr atomda (+) ve (–) yükler birbirine eşittir Örneğin nötr karbon atomunda 6 proton 6 elektron vardır  Nötr atomda, Nötr atomda, p = e’dir  Atomlar elektron alıp verebilirler  Ancak çekirdekte bulunan proton ve nötronu alıp veremezler Ancak çekirdekte bulunan proton ve nötronu alıp veremezler ÖRNEK: Nötr bir magnezyum atomunda proton sayısı 12, nötron sayısı 13’tür  Bu atomun; a  Elektron sayısı nedir? Elektron sayısı nedir?b  Kütle numarası nedir? Kütle numarası nedir?Çözüm a  Nötr atomda elektron ve proton sayısı birbirine eşittir Nötr atomda elektron ve proton sayısı birbirine eşittir O hâlde, p = e = 12 dir O hâlde, p = e = 12 dir b  Kütle no = A = p + n Kütle no = A = p + np = 12, n = 13 olduğuna göre, A = 12 + 13 = 25 (–) yüklü atom Eğer bir atom dışarıdan elektron alırsa, (–) yük sayısı (+) yük sayısından fazla olur  Bu durumda atom (–) yüklü olur Bu durumda atom (–) yüklü olur Örneğin nötr flüor atomunun 9 elektronu, 9 protonu vardır  Flüor atomu 1e– alınca 10 elektronlu ve (–) yüklü olur  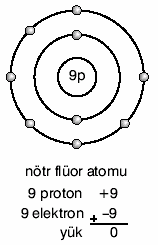 (+) yüklü atom Eğer bir atom bir elektronunu kaybederse, (+) yük sayısı (–) yük sayısından fazla olur  Bu durumda Bu durumdaatom (+) yüklü olur  Örneğin nötr lityum atomunun 3 protonu 3 elektronu vardır  Lityum 1e– verirse 2 elektronlu ve (+) Lityum 1e– verirse 2 elektronlu ve (+)yüklü olur  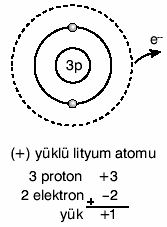 Elementlerin Sembollerle Gösterilmesi Kimyasal hesaplamalarda maddelerin Lâtince isimleriyle işlem yapmak zordur  Bunun yerine elementlerin Lâtince isimlerinin kısaltmalarından oluşan semboller kullanılır Bunun yerine elementlerin Lâtince isimlerinin kısaltmalarından oluşan semboller kullanılır Element sembollerinde ilk harf her zaman büyük, varsa diğerleri daima küçük yazılır  Örneğin; Hidrojen H, Helyum He, Karbon C Kalsiyum Ca, Bor B, Berilyum Be Element sembolünün sol üst köşesine atomun kütle numarası, sol alt köşesine ise atom numarası yazılır  Elektron Dağılımı Elektronlar çekirdek çevresinde belli enerji seviyelerinde ve belli sayılarda dolanır  Enerji seviyeleri çekirdekten dışa doğru, 1 Enerji seviyeleri çekirdekten dışa doğru, 1 seviye, 2 seviye, 2 seviye, 3 seviye, 3 seviye şeklinde sıralanır seviye şeklinde sıralanır Bazen enerji seviyeleri, K, L,M, N Bazen enerji seviyeleri, K, L,M, N   harfleriyle de gösterilir harfleriyle de gösterilir 1  seviyede en fazla 2 elektron bulunur seviyede en fazla 2 elektron bulunur 2  seviyede en fazla 8 elektron bulunur seviyede en fazla 8 elektron bulunur Bir enerji seviyesinde bulunabilecek en fazla elektron sayısı, 2 n2 bağıntısı ile hesaplanır  (n, enerji seviyesini gösterir (n, enerji seviyesini gösterir ) )Atomun en dış enerji seviyesinde en fazla 8 elektron bulunabilir  En dış enerji seviyesinde 8 elektron bulunduran elementlere soy gazlar ya da asal gazlar adı verilir En dış enerji seviyesinde 8 elektron bulunduran elementlere soy gazlar ya da asal gazlar adı verilir Bunun tek istisnası helyumdur Bunun tek istisnası helyumdur Helyum elementi soy gaz olduğu hâlde 2 elektronu vardır Helyum elementi soy gaz olduğu hâlde 2 elektronu vardır Örnek: İlk iki enerji seviyesi dolu olan bir atomun toplam elektron sayısı nedir? Örnek: Atom numarası 13 olan nötr bir atomun elektron dağılımı nasıl olur? Örnek: 18X atomunun elektron dağılımı nasıldır? Örnek: Üçüncü enerji seviyesinde 2 elektron bulunan bir atomun atom numarası kaçtır? A)6 B)10 C) 12 D) 26
__________________
Arkadaşlar, efendiler ve ey millet, iyi biliniz ki, Türkiye Cumhuriyeti şeyhler, dervişler, müritler, meczuplar memleketi olamaz
 En doğru, en hakiki tarikat, medeniyet tarikatıdır En doğru, en hakiki tarikat, medeniyet tarikatıdır |

|
Cevap : Maddenin Yapısı ve Atom - Periyodik Cetvel ve Açıklaması |
|
|
#2 |
|
Şengül Şirin

|
Cevap : Maddenin Yapısı ve Atom - Periyodik Cetvel ve AçıklamasıBUNLARI BİLİYORMUSUNUZ? Atomun çapı yaklaşık 1 angstromdur  1 angström 1 milimetrenin 10 000 000 da birine eşittir 1 angström 1 milimetrenin 10 000 000 da birine eşittir Yani 1 milimetrelik çizgi üzerinde yaklaşık 10 milyon atom yan yana dizilmiş demektir Yani 1 milimetrelik çizgi üzerinde yaklaşık 10 milyon atom yan yana dizilmiş demektir Periyodik Cetvel Elementler benzer özelliklerine göre sınıflandırılırlar  Elementlerin benzer özelliklerine göre sınıflandırılmasıyla oluşturulan tabloya periyodik cetvel denir Elementlerin benzer özelliklerine göre sınıflandırılmasıyla oluşturulan tabloya periyodik cetvel denir Periyodik cetvelde, elementler artan atom numaralarına göre dizilmiş ve benzer özellikteki elementler alt alta gelmiştir Periyodik cetvelde, elementler artan atom numaralarına göre dizilmiş ve benzer özellikteki elementler alt alta gelmiştir Periyodik cetvele periyodik tablo ya da periyodik çizelge de denir Periyodik cetvele periyodik tablo ya da periyodik çizelge de denir Periyodik cetveli oluşturan yatay sıralara periyot adı verilir Periyodik cetveli oluşturan yatay sıralara periyot adı verilir Yatay sıralarda atom numaraları arttıkça, elementlerin fiziksel ve kimyasal özellikleri değişir  Periyodik cetveldeki düşey sütunlara grup denir Periyodik cetveldeki düşey sütunlara grup denir Aynı gruptaki elementler benzer kimyasal özellikler gösterir  Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere 16 tane grup vardır Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere 16 tane grup vardır Periyodik cetvel 18 sütundan oluşur Periyodik cetvel 18 sütundan oluşur B gruplarından üç tanesi birden 8B olarak isimlendirilir B gruplarından üç tanesi birden 8B olarak isimlendirilir Periyodik cetveldeki ilk sütuna 1A grubu denir  Son sütunu ise 8A grubu oluşturur Son sütunu ise 8A grubu oluşturur 1 A grubu elementlerine alkali metaller adı verilir 1 A grubu elementlerine alkali metaller adı verilir Hidrojen 1 A grubunda olduğu hâlde alkali metaller grubuna girmez  7 A grubu elementlerine halojenler, 8A grubu elementlerine soy gazlar adı verilir 7 A grubu elementlerine halojenler, 8A grubu elementlerine soy gazlar adı verilir Grup ve Periyodun Bulunması Bir elementin atom numarası biliniyorsa, bu elementin grup ve periyodu bulunabilir  Örneğin 7N elementinin elektronlarının dağılımı şöyledir: 7N ) ) 2 5 Burada en son enerji seviyesindeki elektron sayısı, grup numarasını; enerji seviyelerinin sayısı ise periyot numarasını verir  Bu sonuçlara göre, 7N elementi 2  periyotta 5 A grubundadır periyotta 5 A grubundadır Örnek 17Cl elementinin periyot ve grup numarasını bulunuz  Değerlik Elektron Sayısı Nötr bir atomun son enerji düzeyindeki elektron sayısına, değerlik elektron sayısı denir  Gruplara göre elementlerin değerlik elektron sayıları şöyledir: Elementlerin Sınıflandırılması Elementler, metaller, ametaller, yarı metaller ve soy gazlar olmak üzere sınıflara ayrılır  Metallerin Genel Özellikleri Periyodik çizelgenin sol tarafında bulunurlar  Parlak ve serttirler  Şekil verilebilirler, tel veya levha hâline gelebilirler  Oda sıcaklığında katı hâlde bulunurlar  Civa (Hg) hariç Civa (Hg) hariç Elektriği ve ısıyı iyi iletirler  Bileşik oluştururken elektron verirler  Elektron verince (+) pozitif yüklü olurlar Elektron verince (+) pozitif yüklü olurlar Kendi aralarında bileşik oluşturmazlar  Ametallerin Genel Özellikleri Periyodik çizelgenin sağ tarafında bulunurlar  Mat görünüşlüdürler  Vurulunca kırılabilirler, şekil verilemezler  Grafit hariç elektrik ve ısıyı iyi iletmezler  Oda sıcaklığında brom sıvı, karbon, kükürt ve bor katı, diğerleri gaz hâldedir  Metallerle yaptıkları bileşiklerde (–) negatif yüklüdürler  Kendi aralarında bileşik oluşturabilirler  Yarı Metaller Periyodik çizelgede metallerle ametalleri ayıran zig-zag çizginin sağ ve solunda bulunurlar  Bazen metal, bazen ametal özellik gösterirler  Bor, silisyum, germanyum, arsenik, antimon, tellür, polonyum ve astatin yarı metallerdir  Soy Gazlar Kararlı yapıya sahiptirler  Elektron alma ve verme eğilimleri yoktur Elektron alma ve verme eğilimleri yoktur Başka maddelerle reaksiyona girmezler  Oda sıcaklığında gaz hâlde bulunurlar  Periyodik çizelgenin en sağında bulunurlar  Periyodik tablonun ortasında yer alan B Grubu elementlerine geçiş elementleri denir  Bunların içinde ağır metaller bulunur Bunların içinde ağır metaller bulunur Element kütlelerinin akb cinsinden gösterilmesi: Periyodik tabloda elementlerin kütleleri yazılırken izotopları da göz önünde bulundurulur  Bir elementin kütlesi, izotop kütleleri göz önüne alınarak hesaplanır Bir elementin kütlesi, izotop kütleleri göz önüne alınarak hesaplanır Klor elementi tabiatta % 75 oranında 35Cl şeklinde, % 25 oranında da 37Cl izotopları şeklinde bulunur  Cl elementinin ortalama kütlesi şöyle hesaplanır: Cl elementinin ortalama kütlesi şöyle hesaplanır: Klor elementinin atom kütlesi Klor elementinin ortalama kütlesi 35,5 akb dir  Bu yüzden Klor elementi periyodik tabloda 35,5Cl şeklinde gösterilir Bu yüzden Klor elementi periyodik tabloda 35,5Cl şeklinde gösterilir 75/100 x 35 + 25/100 x 37 = 35,5 akb 1  Ametalik özellik hangi elementte en fazladır? Ametalik özellik hangi elementte en fazladır?A)X B) Y C) Z D) T 2  Metalik özellik hangi elementte en fazladır? Metalik özellik hangi elementte en fazladır?A)X B) Y C) Z D) T 3  Hangi element kararlı yapıdadır? Hangi element kararlı yapıdadır?A)X B) Y C) Z D) T 4  Değerlik elektron sayısı ile ilgili olarak aşağıdakilerden Değerlik elektron sayısı ile ilgili olarak aşağıdakilerdenhangisi yanlıştır? Element Değerlik e– sayısı A) X 1B) Y 5 C) Z 2 D) T 0 5  Atom numarası en küçük olan element hangisidir? Atom numarası en küçük olan element hangisidir?A)X B) Y C) Z D) T
__________________
Arkadaşlar, efendiler ve ey millet, iyi biliniz ki, Türkiye Cumhuriyeti şeyhler, dervişler, müritler, meczuplar memleketi olamaz
 En doğru, en hakiki tarikat, medeniyet tarikatıdır En doğru, en hakiki tarikat, medeniyet tarikatıdır |

|
Üye olmanıza kesinlikle gerek yok !
Konuya yorum yazmak için sadece buraya tıklayınız.
Bu sitede 1 günde 10.000 kişiye sesinizi duyurma fırsatınız var.
IP adresleri kayıt altında tutulmaktadır. Aşağılama, hakaret, küfür vb. kötü içerikli mesaj yazan şahıslar IP adreslerinden tespit edilerek haklarında suç duyurusunda bulunulabilir.
Konuya yorum yazmak için sadece buraya tıklayınız.
Bu sitede 1 günde 10.000 kişiye sesinizi duyurma fırsatınız var.
IP adresleri kayıt altında tutulmaktadır. Aşağılama, hakaret, küfür vb. kötü içerikli mesaj yazan şahıslar IP adreslerinden tespit edilerek haklarında suç duyurusunda bulunulabilir.
«
Önceki Konu
|
Sonraki Konu
»
|
|
ForumSinsi.com hakkında yapılacak tüm şikayetlerde ilgili adresimizle iletişime geçilmesi halinde kanunlar ve yönetmelikler çerçevesinde en geç 1 (Bir) Hafta içerisinde gereken işlemler yapılacaktır. İletişime geçmek için buraya tıklayınız.



