Periyodik Tablo |
|
|
#1 |
|
Şengül Şirin

|
Periyodik TabloPeriyodik cetvel elementlerin kimyasal ve fiziksel özelliklerini periyodik olarak gösteren çizelge  Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin araştırılması fizik ve kimyacıları ilgilendirmiştir Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin araştırılması fizik ve kimyacıları ilgilendirmiştir Gerçi benzer özelliklerdeki elementlerin sıralanabilmesi için bilinen elementlerin özelliklerinin öncelikle ortaya konulması gerekir Gerçi benzer özelliklerdeki elementlerin sıralanabilmesi için bilinen elementlerin özelliklerinin öncelikle ortaya konulması gerekir Altın, gümüş, kalay, bakır, kurşun ve cıva gibi elementler eski çağlardan beri biliniyordu Altın, gümüş, kalay, bakır, kurşun ve cıva gibi elementler eski çağlardan beri biliniyordu    B ugünkü anlama yakın periyodik sistem, 1869 yılında Rus kimyacısı Dimitri Mendeleev tarafında yapılmıştır  1877 yılında Alman bilgini Lothar Meyer de Mendeleev''den habersiz olarak bir periyodik cetvel yapmıştır 1877 yılında Alman bilgini Lothar Meyer de Mendeleev''den habersiz olarak bir periyodik cetvel yapmıştır Bu iki cetvel hemen hemen birbirinin aynıdır Bu iki cetvel hemen hemen birbirinin aynıdır Meyer; elementleri, cetvelinde fiziksel özelliklerine göre sıralamış, Mendeleev ise elementlerin atom kütlelerini dikkate alarak artan atom kütlelerine göre cetvelinde sıralamıştır Meyer; elementleri, cetvelinde fiziksel özelliklerine göre sıralamış, Mendeleev ise elementlerin atom kütlelerini dikkate alarak artan atom kütlelerine göre cetvelinde sıralamıştır  Mendeleev MendeleevPeriyodik cetvel elementlerin Element Alm  Element (n), Urstoff (m), Fr Element (n), Urstoff (m), Fr Elément (m), İng Elément (m), İng Element Element Kimyasal metodlarla daha basit maddelere ayrışması mümkün olmayan basit madde Kimyasal metodlarla daha basit maddelere ayrışması mümkün olmayan basit madde Su bir element değildir Su bir element değildir Fakat suyun elektrolizinden elde edilen hidrojen ve oksijen birer elementtir Fakat suyun elektrolizinden elde edilen hidrojen ve oksijen birer elementtir Saf şeker bir element değildir Saf şeker bir element değildir Çünkü şekerden karbon, hidrojen ve oksijen çıkarılabilir Çünkü şekerden karbon, hidrojen ve oksijen çıkarılabilir Element, aynı cins ve kimya tepkimelerinde bölünmeyen en küçük parçaların yığınıdır  Bu parçalara atom denir Bu parçalara atom denir Far Far   kimyasal ve Kimya, element ya da bileşik haldeki maddelerin yapısını, bileşimini ve özelliklerini, uğradıkları dönüşümleri, bu dönüşümler sırasında açığa çıkardıkları ya da soğurdukları enerjiyi inceleyen bilim dalı  Doğal halde bulunan ya da yapay olarak (bireşim yoluyla) üretilen her madde, element olarak tanımlanan bir ya da daha çok atom türü içerir Doğal halde bulunan ya da yapay olarak (bireşim yoluyla) üretilen her madde, element olarak tanımlanan bir ya da daha çok atom türü içerir Kendileri de daha küçük temel parçacıklardan oluşmakla birlikte, kimyasal maddelerin temel yapı birimleri atomlardır Kendileri de daha küçük temel parçacıklardan oluşmakla birlikte, kimyasal maddelerin temel yapı birimleri atomlardır Bu nedenle kimya, temel parçac Bu nedenle kimya, temel parçac   fiziksel özelliklerini periyodik olarak gösteren çizelge  Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin araştırılması Fizik, gözlenebilir evrenin temel bileşenleri arasındaki etkileşmelere ve maddenin yapısına ilişkin temel sorunlarla ilgilenen bilim Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin araştırılması Fizik, gözlenebilir evrenin temel bileşenleri arasındaki etkileşmelere ve maddenin yapısına ilişkin temel sorunlarla ilgilenen bilim Fizik sözcüğü, Eski Yunancada "doğa" anlamına gelen physis'ten türemiştir Fizik sözcüğü, Eski Yunancada "doğa" anlamına gelen physis'ten türemiştir Uzun süre doğa felsefesi olarak anılan fizik, doğanın makroskopik ve mikroskopik tüm görünümlerini inceleme konusu olarak seçmiştir Uzun süre doğa felsefesi olarak anılan fizik, doğanın makroskopik ve mikroskopik tüm görünümlerini inceleme konusu olarak seçmiştir    fizik ve kimyacıları ilgilendirmiştir  Gerçi benzer özelliklerdeki elementlerin sıralanabilmesi için bilinen elementlerin özelliklerinin öncelikle ortaya konulması gerekir Gerçi benzer özelliklerdeki elementlerin sıralanabilmesi için bilinen elementlerin özelliklerinin öncelikle ortaya konulması gerekir Fizik, gözlenebilir evrenin temel bileşenleri arasındaki etkileşmelere ve maddenin yapısına ilişkin temel sorunlarla ilgilenen bilim Fizik, gözlenebilir evrenin temel bileşenleri arasındaki etkileşmelere ve maddenin yapısına ilişkin temel sorunlarla ilgilenen bilim Fizik sözcüğü, Eski Yunancada "doğa" anlamına gelen physis'ten türemiştir Fizik sözcüğü, Eski Yunancada "doğa" anlamına gelen physis'ten türemiştir Uzun süre doğa felsefesi olarak anılan fizik, doğanın makroskopik ve mikroskopik tüm görünümlerini inceleme konusu olarak seçmiştir Uzun süre doğa felsefesi olarak anılan fizik, doğanın makroskopik ve mikroskopik tüm görünümlerini inceleme konusu olarak seçmiştir    Altın, Alm  Gold (n), Fr Gold (n), Fr Or (n), İng Or (n), İng Gold Gold Kimyada Au sembolü ile gösterilen yumuşak, parlak sarı renkte metalik bir element Kimyada Au sembolü ile gösterilen yumuşak, parlak sarı renkte metalik bir element Atom numarası 79, atom ağırlığı 196,967, erime noktası 1063°C, kaynama noktası 2966°C ve 20°C’de özgül ağırlığı 19,3 g/cm3tür Atom numarası 79, atom ağırlığı 196,967, erime noktası 1063°C, kaynama noktası 2966°C ve 20°C’de özgül ağırlığı 19,3 g/cm3tür gümüş, Alm  Silber (n), Fr Silber (n), Fr Argent (m), İng Argent (m), İng Silver Silver Kimyâda simgesi Ag olan, beyaz, parlak, kıymetli bir metalik element Kimyâda simgesi Ag olan, beyaz, parlak, kıymetli bir metalik element Atom numarası 47, atom ağırlığı 107,87’dir Atom numarası 47, atom ağırlığı 107,87’dir Erime noktası 961,9°C, kaynama noktası 1950°C ve özgül ağırlığı da 10,5 gr/cm3tür Erime noktası 961,9°C, kaynama noktası 1950°C ve özgül ağırlığı da 10,5 gr/cm3tür Çoğu bileşiklerinde +1 değerliklidir Çoğu bileşiklerinde +1 değerliklidir Ag sembolü Lâtince argentum kelimesinden gelir Ag sembolü Lâtince argentum kelimesinden gelir kalay, Yumuşak, haddelenebilir (tel ve levha hâline gelebilir), gümüş beyazlığında metalik bir element  Târihçesi mîlâttan önce 3000 yıllarına dayanır Târihçesi mîlâttan önce 3000 yıllarına dayanır Mısır’da ve Mezopotamya’da bronz alaşımında kalay kullanılmıştır Mısır’da ve Mezopotamya’da bronz alaşımında kalay kullanılmıştır Mîlâttan önce 2000 yıllarında bakır orta doğuda tam kullanıldığı hâlde kalayın kullanılışı sınırlıydı Mîlâttan önce 2000 yıllarında bakır orta doğuda tam kullanıldığı hâlde kalayın kullanılışı sınırlıydı Bu târihlerde kalay, İran ve Kafkasya’da elde ediliyordu Bu târihlerde kalay, İran ve Kafkasya’da elde ediliyordu   bakır, Alm  Kupfer, Fr Kupfer, Fr Cuivre, İng Cuivre, İng Copper Copper Sembolü Cu olan bir metal Sembolü Cu olan bir metal Kırmızı renklidir Kırmızı renklidir Takriben M Takriben M Ö Ö 8000 yıllarında kullanıldığı bilinmektedir 8000 yıllarında kullanıldığı bilinmektedir Özellikleri: Periyodik cetvelde 1B grubundadır  Hakiki metal olup, eksi değerleri yoktur Hakiki metal olup, eksi değerleri yoktur Gümüş ve altın ile aynı gruptandır Gümüş ve altın ile aynı gruptandır Atom numarası 29, Atom ağırlığı 63,546’dır Atom numarası 29, Atom ağırlığı 63,546’dır     kurşun ve Atom numarası: 82 Simge: Pb Kütle numarası: 207  19 Kaynama Noktası (C): 1725 Erime Noktası (C): 327 19 Kaynama Noktası (C): 1725 Erime Noktası (C): 327 4 Yoğunluk: 11 4 Yoğunluk: 11 4 Buharlaşma Isısı: 42 4 Buharlaşma Isısı: 42 2 Kaynaşma (Füzyon) Isısı: 1 2 Kaynaşma (Füzyon) Isısı: 1 22 Elektriksel iletkenlik: 0 22 Elektriksel iletkenlik: 0 046 Isıl iletkenlik: 0 046 Isıl iletkenlik: 0 083 Özgül Isı Kapasitesi: 0 083 Özgül Isı Kapasitesi: 0 031 031  cıva gibi elementler eski çağlardan beri biliniyordu  Bir elementin ilk bilimsel olarak bulunması Cıva, periyodik tablo|periyodik tablodaki sembolü "Hg" ve atom numarası ise 80 olan, kimya|kimyasal bir element|elementdir Bir elementin ilk bilimsel olarak bulunması Cıva, periyodik tablo|periyodik tablodaki sembolü "Hg" ve atom numarası ise 80 olan, kimya|kimyasal bir element|elementdir "Hg" sembolü, Latince'deki ''hydrargyrum'' (sulu/sıvı gümüş) sözcüğünden gelir "Hg" sembolü, Latince'deki ''hydrargyrum'' (sulu/sıvı gümüş) sözcüğünden gelir Cıva için İngilizce'de ise iki sözcük kullanılır: "''mercury''" ve "''quicksilver''" (çabuk gümüş) Cıva için İngilizce'de ise iki sözcük kullanılır: "''mercury''" ve "''quicksilver''" (çabuk gümüş) 1649 yılında 1649 yılı olayları, ölümler, doğumlar ve diğer önemli gelişmeler  Henning Brand’ın fosforu bulmasıyla başlar  Bundan sonraki 200 yıl boyunca elementler ve onları bileşikleri hakkında Bundan sonraki 200 yıl boyunca elementler ve onları bileşikleri hakkında kimyacılar tarafından pekçok bilgi elde edildi  Bununla beraber 1869 yılına kadar toplam 63 1869 yılı olayları, ölümler, doğumlar ve diğer önemli gelişmeler Bununla beraber 1869 yılına kadar toplam 63 1869 yılı olayları, ölümler, doğumlar ve diğer önemli gelişmeler   element bulunabilmişti  Bilinen elementlerin sayısı arttıkça, bilim adamları elementlerin özelliklerinin belli kalıplara oturduğunu anlamaya başladılar Bilinen elementlerin sayısı arttıkça, bilim adamları elementlerin özelliklerinin belli kalıplara oturduğunu anlamaya başladılar Element Alm  Element (n), Urstoff (m), Fr Element (n), Urstoff (m), Fr Elément (m), İng Elément (m), İng Element, aynı cins ve kimya tepkimelerinde bölünmeyen en küçük parçaların yığınıdır  Bu parçalara atom denir Bu parçalara atom denir Far Far   Detaylı bilgi için linke tıklayınız Detaylı bilgi için linke tıklayınız Element Element Kimyasal metodlarla daha basit maddelere ayrışması mümkün olmayan basit madde Kimyasal metodlarla daha basit maddelere ayrışması mümkün olmayan basit madde Su bir element değildir Su bir element değildir Fakat suyun elektrolizinden elde edilen hidrojen ve oksijen birer elementtir Fakat suyun elektrolizinden elde edilen hidrojen ve oksijen birer elementtir Saf şeker bir element değildir Saf şeker bir element değildir Çünkü şekerden karbon, hidrojen ve oksijen çıkarılabilir Çünkü şekerden karbon, hidrojen ve oksijen çıkarılabilir 1817 yılında   Johann Dobereiner benzer kimyasal özellikler sahip olan stronsiyum, kalsiyum ve Atom numarası: 20 Simge: Ca Kütle numarası: 40  08 Kaynama Noktası (C): 1440 Erime Noktası (C): 838 Yoğunluk: 1 08 Kaynama Noktası (C): 1440 Erime Noktası (C): 838 Yoğunluk: 1 55 Buharlaşma Isısı: 36 55 Buharlaşma Isısı: 36 74 Kaynaşma (Füzyon) Isısı: 2 74 Kaynaşma (Füzyon) Isısı: 2 1 Elektriksel iletkenlik: 1 Elektriksel iletkenlik:  218 Isıl iletkenlik: 218 Isıl iletkenlik:  3 Özgül Isı Kapasitesi: 3 Özgül Isı Kapasitesi:  149 149baryuma bakarak, stronsiyumun atom ağırlığının kalsiyum ve baryum atom ağırlıklarının ortasında olduğuna dikkat çekti  Baryum Alm Baryum Alm Barium, Fr Barium, Fr Barium, İng Barium, İng Barium Barium Toprak alkali metaller sınıfından bir element Toprak alkali metaller sınıfından bir element Periyodik sistemin 2A grubunda yer alır Periyodik sistemin 2A grubunda yer alır Kimyasal sembolü (Ba)’dır Kimyasal sembolü (Ba)’dır Atom numarası 56, atom ağırlığı 137,34’tür Atom numarası 56, atom ağırlığı 137,34’tür Kütle numaraları 130, 132, 134, 136, 137 ve 138 olan izotopları kararlıdır Kütle numaraları 130, 132, 134, 136, 137 ve 138 olan izotopları kararlıdır Baryum 138, en çok bulunan izotopudur Baryum 138, en çok bulunan izotopudur Elektron düzeni (Xe) 6S2 şeklindedir Elektron düzeni (Xe) 6S2 şeklindedir 6S2 elekronları valans (değerlik) elektronlarıdır 6S2 elekronları valans (değerlik) elektronlarıdır Kimyasal reaksiyonlarda bu iki elektronunu vererek + 2 değerlikli Ba2+ iyonunu meydan Kimyasal reaksiyonlarda bu iki elektronunu vererek + 2 değerlikli Ba2+ iyonunu meydan1829 yılında 1829 yılı olayları, ölümler, doğumlar ve diğer önemli gelişmeler    klor, Halojenler sınıfından bir element  Kimyâsal sembolü Cl’dir Kimyâsal sembolü Cl’dir Tabiatta halojenlerin en çok bulunanıdır Tabiatta halojenlerin en çok bulunanıdır İlk defa 1774’te Scheele tarafından klorür asidinin piroluzit ile yükseltgenmesiyle elde edildi İlk defa 1774’te Scheele tarafından klorür asidinin piroluzit ile yükseltgenmesiyle elde edildi O zaman klora, flogistonsuz tuz asidi adı verildi O zaman klora, flogistonsuz tuz asidi adı verildi 1810’da Davy tarafından, kimyevî bir element olduğu belirlendi ve sarı yeşil anlamına gelmek üzere “klor” diye adlandırıldı 1810’da Davy tarafından, kimyevî bir element olduğu belirlendi ve sarı yeşil anlamına gelmek üzere “klor” diye adlandırıldı    brom ve Alm  Brom (n), Fr Brom (n), Fr Brome (m Brome (m ), İng ), İng Bromine Bromine Br sembolü ile gösterilen halojenler sınıfından bir element Br sembolü ile gösterilen halojenler sınıfından bir element Peryodik cetvelde VII A grubunda bulunur Peryodik cetvelde VII A grubunda bulunur Leş kokulu anlamında olan brom ilk defâ Fransız kimyâcısı Antoine Balard tarafından elde edildi Leş kokulu anlamında olan brom ilk defâ Fransız kimyâcısı Antoine Balard tarafından elde edildi    iyot üçlüsünün de benzer özellikler gösterdiği bulundu  Yine benzer davranış lityum, sodyum ve potasyum için de gözleniyordu Yine benzer davranış lityum, sodyum ve potasyum için de gözleniyordu 1829 ve 1858 yılları arasında bu konuda pek çok araştırma yapıldı 1829 ve 1858 yılları arasında bu konuda pek çok araştırma yapıldı Bu sırada halojenler grubuna katıldı Bu sırada halojenler grubuna katıldı Oksijen, kükürt, selenyum ve tellür bir grubun üyesi olarak düşünülürken azot, fosfor, arsenik, antimon ve bizmut başka bir grup içine yerleştirildiler Oksijen, kükürt, selenyum ve tellür bir grubun üyesi olarak düşünülürken azot, fosfor, arsenik, antimon ve bizmut başka bir grup içine yerleştirildiler 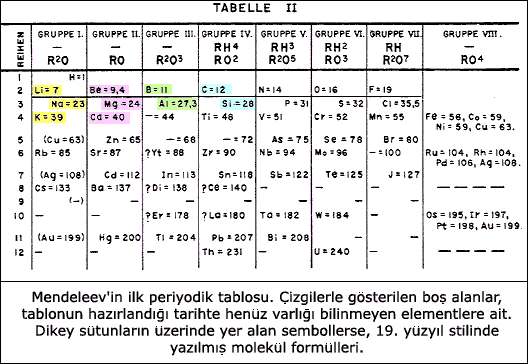 Mendeleev''in oluşturduğu Periyodik tablo Mendeleev''in oluşturduğu Periyodik tabloİlk periyodik tabloyu oluşturma şerefi Fransız bilim adamı A  E E Beguyer de Chancourtois''e düştü Beguyer de Chancourtois''e düştü De Chancourtois, silindirin çevresine 16 kütle birimleri yerleştirerek elementleri buraya oturttu De Chancourtois, silindirin çevresine 16 kütle birimleri yerleştirerek elementleri buraya oturttu Benzer özelliklerdeki elementler bu silindir üzerinde düşey satırlarda yer alıyordu Benzer özelliklerdeki elementler bu silindir üzerinde düşey satırlarda yer alıyordu De Chancourtois, "Elementlerin özellikleri sayıların özellikler ile ilişkilidir" dedi ve her yedi elementte bir özelliklerin tekrarlandığının farkına vardı De Chancourtois, "Elementlerin özellikleri sayıların özellikler ile ilişkilidir" dedi ve her yedi elementte bir özelliklerin tekrarlandığının farkına vardı Bu tablo kullanılarak birkaç metal oksidin stokiyometrisi önceden tanımlanabildi Bu tablo kullanılarak birkaç metal oksidin stokiyometrisi önceden tanımlanabildi Ne yazık ki bu cetvel üzerinde elementlerden başka bazı iyonlar ve elementlerde yer alıyordu Ne yazık ki bu cetvel üzerinde elementlerden başka bazı iyonlar ve elementlerde yer alıyordu İngiliz kimyacı John Newlands 1863 yazdığı bir yazıda benzer fiziksel özelliklere göre elementleri 11 gruba ayırmıştı  Atom ağırlıkları sekizin katı kadar olan elementlerin özellikleri benzerdi Atom ağırlıkları sekizin katı kadar olan elementlerin özellikleri benzerdi 1864 yılında yazılan bir yazıda Newlands bunu Oktav kanunu ('Law of Octaves') olarak tanımladı 1864 yılında yazılan bir yazıda Newlands bunu Oktav kanunu ('Law of Octaves') olarak tanımladı Bu kanuna göre herhangi bir element tablodaki sekizinci elementle benzerlikler gösteriyordu Bu kanuna göre herhangi bir element tablodaki sekizinci elementle benzerlikler gösteriyordu Genelde periyodik tablonun babası olarak Alman bilim adamı Lother MeyerDmitri Mendeleev kabul edilir  Her ikisi de birbirinden habersi olarak dikkate değer benzer sonuçlar ürettiler Her ikisi de birbirinden habersi olarak dikkate değer benzer sonuçlar ürettiler Mendeleev atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlandığını görmüştür Mendeleev atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlandığını görmüştür Daha sonra elementleri tekrarlanan özelliklerine göre alt alta sıralayarak ilk iki periyodu yedişer, sonraki üç periyodu ise onyedişer element içeren bir periyodik sistem hazırlamıştır Daha sonra elementleri tekrarlanan özelliklerine göre alt alta sıralayarak ilk iki periyodu yedişer, sonraki üç periyodu ise onyedişer element içeren bir periyodik sistem hazırlamıştır Mendeleev''in hazırladığı periyodik sistemde bazı yerleri henüz keşfedilmemiş elementlerin olduğunu düşünerek boş bırakmıştır Mendeleev''in hazırladığı periyodik sistemde bazı yerleri henüz keşfedilmemiş elementlerin olduğunu düşünerek boş bırakmıştır Daha sonra bulunan skandiyum, galyum, germanyum Daha sonra bulunan skandiyum, galyum, germanyum1895 yılında Lord Rayleigh, kimyasal olarak inert yeni bir gazı ( argon) keşfettiğini bildirdi  Bu element periyodik tabloda bilinen hiçbir yere oturtulamadı Bu element periyodik tabloda bilinen hiçbir yere oturtulamadı 1898 yılında William Ramsey bu elementin klor ile potasyumHelyumda aynı grubun bir üyesi olarak düşünüldü 1898 yılında William Ramsey bu elementin klor ile potasyumHelyumda aynı grubun bir üyesi olarak düşünüldü Bu grup elementlerinin değerliklerinin sıfır olması nedeniyle sıfır grubu olarak adlandırıldı Bu grup elementlerinin değerliklerinin sıfır olması nedeniyle sıfır grubu olarak adlandırıldı Mendeleev''in periyodik tablosu her ne kadar elementlerin periyodik özelliklerini gösterse de neden özelliklerin tekrarlandığı konusunda herhangi bir bilgi vermemektedir  1911 de Ernest Rutherford atom çekirdekleri alfa parçacıklarının saçılması deneyiyle çekirdek yükünün belirlenebileceğini gösterdi  Rutherford''un gösterdiği diğer bir şey bir çekirdeğin yükünün atom ağırlığı ile orantılı olduğuydu Rutherford''un gösterdiği diğer bir şey bir çekirdeğin yükünün atom ağırlığı ile orantılı olduğuydu Yine 1911 de A Yine 1911 de A Van den Broek bir seri çalışmasıyla elementlerin atom ağırlıklarının atom üzerindeki yüke yaklaşık eşit olduğunu gösterdi Van den Broek bir seri çalışmasıyla elementlerin atom ağırlıklarının atom üzerindeki yüke yaklaşık eşit olduğunu gösterdi Bu yük daha sonra atom numarası olarak tanımlandı ve periyodik tablodaki elementleri yerleştirmede kullanıldı Bu yük daha sonra atom numarası olarak tanımlandı ve periyodik tablodaki elementleri yerleştirmede kullanıldı 1913 de Henry Moseley bir grup elementin X-ışınlar spektrum çizgilerin dalga boylarını ölçerek, atom numarası ile elementlerin X-ışınları dalga boylarının ilişkili olduğunu gösterdi 1913 de Henry Moseley bir grup elementin X-ışınlar spektrum çizgilerin dalga boylarını ölçerek, atom numarası ile elementlerin X-ışınları dalga boylarının ilişkili olduğunu gösterdi Bu çalışma Mendeleev, Mayer ve diğerlerinin yaptığı gibi atom ağırlıklarını temel seçmedeki yanlışlığı gösteriyordu Bu çalışma Mendeleev, Mayer ve diğerlerinin yaptığı gibi atom ağırlıklarını temel seçmedeki yanlışlığı gösteriyordu Fakat neden periyodik özellikler gözleniyor sorusunun yanıtı ise Niels Bohr un elementlerdeki elektronik yapıyı incelemesiyle başlar diyebilir  Periyodik tablodaki en son büyük değişiklik, 20  yüzyılın ortalarında Glenn Seaborg''un çalışmasıyla ortaya çıktı yüzyılın ortalarında Glenn Seaborg''un çalışmasıyla ortaya çıktı 1940 da plutonyumu bulmasıyla başlayan araştırması, 94 den 102 ye kadar olan tüm uranyum ötesi elementlerin bulmasıyla sürdü 1940 da plutonyumu bulmasıyla başlayan araştırması, 94 den 102 ye kadar olan tüm uranyum ötesi elementlerin bulmasıyla sürdü Periyodik tablodaki lantanit serisinin altına aktinitler serisini yerleştirdi Periyodik tablodaki lantanit serisinin altına aktinitler serisini yerleştirdi 1951 de Seaborg bu çalışmaları ile kimyada Nobel ödülünü kazandı 1951 de Seaborg bu çalışmaları ile kimyada Nobel ödülünü kazandı 106 nolu element seaborgiyum (Sg) olarak adlandırıldı 106 nolu element seaborgiyum (Sg) olarak adlandırıldı ve Rus bilim adamı elementleri tablodaki boşluklara yerleşmişlerdir ve Rus bilim adamı elementleri tablodaki boşluklara yerleşmişlerdir arasında bir yere konulabileceğini önerdi arasında bir yere konulabileceğini önerdi Periyodik cetvel elementlerin elektron dizilişine bağlı olarak dört bloktan meydana gelir Periyodik cetvel elementlerin elektron dizilişine bağlı olarak dört bloktan meydana gelir Cetvelde yatay sütunlara periyot, düşey sütunlara grup denir Cetvelde yatay sütunlara periyot, düşey sütunlara grup denir Periyodik cetvel 7 periyot ile 8A, 8B grubu olmak üzere 16 gruptan oluşur Periyodik cetvel 7 periyot ile 8A, 8B grubu olmak üzere 16 gruptan oluşur 4 4 ve 5 ve 5 periyotlarda periyodun 10 element uzamasına d orbitalinin dolması neden olur periyotlarda periyodun 10 element uzamasına d orbitalinin dolması neden olur 6 6 ve 7 ve 7 periyotlarda ise sıranın 14 element uzamasına f orbitalinin dolması neden olur periyotlarda ise sıranın 14 element uzamasına f orbitalinin dolması neden olur F orbitaline elektron dolan 14 elementten 6 F orbitaline elektron dolan 14 elementten 6 sıradaki lantanitler ve 7 sıradaki lantanitler ve 7 sıradaki aktinitler, cetvelin daha fazla uzamaması için alt sırada f bloğuna alınmıştır sıradaki aktinitler, cetvelin daha fazla uzamaması için alt sırada f bloğuna alınmıştır Periyodik cetvelin s bloğunda IA ve IIA, p bloğunda IIIA, IVA, VA, VIA, VIIA ve 0 grupları, d bloğunda ise IIIB, IVB, VB, VIB, VIIB, VIIIB, IB ve IIB grupları yer alır  Elementler artan atom numaralarına göre periyodik cetvele yerleştirildiğinde, cetvelin sol tarafında metallerin sağ tarafında ametallerin yer aldığı görülür  Ana Özellikleri: (Görünüm Özellikleri) 1- Periyodik cetvel 4 ana bloktan oluşmuştur; s, p, d ve f 2- Periyodik cetvelde, her biri bir enerji seviyesine karşılık gelen 7 tane periyot (satır) vardır  3- Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere toplam 16 tane GRUP var 3- Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere toplam 16 tane GRUP var Ancak 8B grubu 3 sütundan oluşmuştur Ancak 8B grubu 3 sütundan oluşmuştur 4- Birinci periyot hariç her periyot bir alkali metal ile başlar 4- Birinci periyot hariç her periyot bir alkali metal ile başlar Her periyot bir soy gaz ile biter Her periyot bir soy gaz ile biter (IA grubundaki H aslında başlı başına bir gruptur (IA grubundaki H aslında başlı başına bir gruptur Ancak bir çok özelliği IA''ya yakın olduğundan bu grupta gösterilir Ancak bir çok özelliği IA''ya yakın olduğundan bu grupta gösterilir ) 5- B gruplarının genel adı GEÇİŞ ELEMENTLERİ olarak adlandırılır ) 5- B gruplarının genel adı GEÇİŞ ELEMENTLERİ olarak adlandırılır 6- Periyodik cetvelin altındaki f bloğu ise İÇ GEÇİŞ ELEMENTLERİ olarak adlandırılır 6- Periyodik cetvelin altındaki f bloğu ise İÇ GEÇİŞ ELEMENTLERİ olarak adlandırılır Alt grupları ise LANTANİTLER ve AKTİNİTLERDİR 7- Metaller ve a-Metaller 8- Periyodik cetvelin; Alt grupları ise LANTANİTLER ve AKTİNİTLERDİR 7- Metaller ve a-Metaller 8- Periyodik cetvelin;1  PERİYOTTA = 2 ELEMENT 2 PERİYOTTA = 2 ELEMENT 2 PERİYOTTA = 8 ELEMENT 3 PERİYOTTA = 8 ELEMENT 3 PERİYOTTA = 8 ELEMENT 4 PERİYOTTA = 8 ELEMENT 4 PERİYOTTA = 18 ELEMENT 5 PERİYOTTA = 18 ELEMENT 5 PERİYOTTA = 18 ELEMENT 6 PERİYOTTA = 18 ELEMENT 6 PERİYOTTA = 32 ELEMENT 7 PERİYOTTA = 32 ELEMENT 7 PERİYOTTA = 32 ELEMENT PERİYOTTA = 32 ELEMENTBulunur  Ayrıca Lantanit ve Aktinit serisinde de 14''er element bulunur Ayrıca Lantanit ve Aktinit serisinde de 14''er element bulunur Bunlar 6 ve 7 Bunlar 6 ve 7 periyot elementlerindir periyot elementlerindir(Kimyasal Özellikleri) SOLDAN → SAĞA doğru 1  Atom numarası artar Atom numarası artar 2 2 Kütle numarası artar 3 Kütle numarası artar 3 Değerlik elektron sayısı artar Değerlik elektron sayısı artar 4 4 İyonlaşma enerjisi artar İyonlaşma enerjisi artar 5 5 Ametalik özellik artar Ametalik özellik artar a) Elektron alma isteği artar  b) Oksitli bileşiklerinin sulu çözeltisinde asit özelliği artar b) Oksitli bileşiklerinin sulu çözeltisinde asit özelliği artar c) Hidrojenli bileşiklerinde asit özelliği artar c) Hidrojenli bileşiklerinde asit özelliği artar d) Ametalik aktiflik artar d) Ametalik aktiflik artar 6  Son enerji seviyesi değişmez Son enerji seviyesi değişmez 7 7 Atom hacmi azalır Atom hacmi azalır Grup123456789101112131415161718Periyot11 H2 He23 Li4 Be5 B6 C7 N8 O9 F10 Ne311 Na12 Mg13 Al14 Si15 P16 S17 Cl18 Ar419 K20 Ca21 Sc22 Ti23 V24 Cr25 Mn26 Fe27 Co28 Ni29 Cu30 Zn31 Ga32 Ge33 As34 Se35 Br36 Kr537 Rb38 Sr39 Y40 Zr41 Nb42 Mo43 Tc44 Ru45 Rh46 Pd47 Ag48 Cd49 In50 Sn51 Sb52 Te53 I54 Xe655 Cs56 Ba71 Lu72 Hf73 Ta74 W75 Re76 Os77 Ir78 Pt79 Au80 Hg81 Tl82 Pb83 Bi84 Po85 At86 Rn787 Fr 88 Ra103 Lr104 Rf105 Db106 Sg107 Bh108 Hs109 Mt110 Ds111 Uuu112 Uub113 Uut114 Uuq115 Uup116 Uuh117 Uus118 UuoLantanitler57 La58 Ce59 Pr60 Nd61 Pm62 Sm63 Eu64 Gd65 Tb66 Dy67 Ho68 Er69 Tm70 YbAktinitler89 Ac90 Th91 Pa92 U93 Np94 Pu95 Am96 Cm97 Bk98 Cf99 Es100 Fm101 Md102 No Periyodik cetvelde kimyasal seriler Alkalimetaller Alkalinler Lantanitler Aktinitler Geçiş metalleriMetaller MetaloidlerAmetallerHalojenlerAsilgazlar |

|
Üye olmanıza kesinlikle gerek yok !
Konuya yorum yazmak için sadece buraya tıklayınız.
Bu sitede 1 günde 10.000 kişiye sesinizi duyurma fırsatınız var.
IP adresleri kayıt altında tutulmaktadır. Aşağılama, hakaret, küfür vb. kötü içerikli mesaj yazan şahıslar IP adreslerinden tespit edilerek haklarında suç duyurusunda bulunulabilir.
Konuya yorum yazmak için sadece buraya tıklayınız.
Bu sitede 1 günde 10.000 kişiye sesinizi duyurma fırsatınız var.
IP adresleri kayıt altında tutulmaktadır. Aşağılama, hakaret, küfür vb. kötü içerikli mesaj yazan şahıslar IP adreslerinden tespit edilerek haklarında suç duyurusunda bulunulabilir.
«
Önceki Konu
|
Sonraki Konu
»
|
|
ForumSinsi.com hakkında yapılacak tüm şikayetlerde ilgili adresimizle iletişime geçilmesi halinde kanunlar ve yönetmelikler çerçevesinde en geç 1 (Bir) Hafta içerisinde gereken işlemler yapılacaktır. İletişime geçmek için buraya tıklayınız.





